
自2016年3月5日國務(wù)院辦公廳印發(fā)《關(guān)于開展仿制藥質(zhì)量和療效一致性評價(jià)的意見》(國辦發(fā)〔2016〕8號)起,歷經(jīng)四年,一致性評價(jià)相關(guān)改革工作有條不紊的推進(jìn),越來越多的仿制藥通過一致性評價(jià)考驗(yàn),質(zhì)量和療效與原研藥品達(dá)到一致。
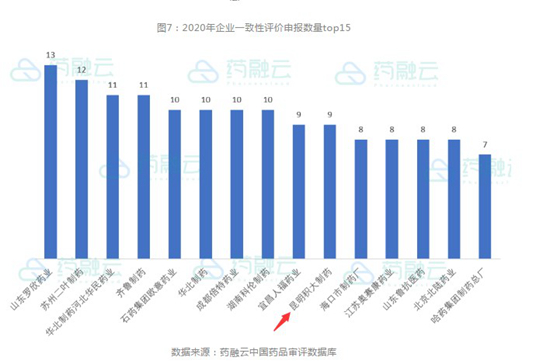
2020年,一致性評價(jià)申報(bào)受理引人關(guān)注。據(jù)藥融云中國藥品審評數(shù)據(jù)庫數(shù)據(jù),共有390家企業(yè)的一致性評價(jià)品種被受理。受理號最多的是山東羅欣藥業(yè),受理號數(shù)量達(dá)到13個(gè);其次是蘇州二葉制藥,受理號個(gè)數(shù)都為12個(gè);華北制藥河北華民藥業(yè)和齊魯制藥位居第三,有11個(gè)受理號;華北制藥、成都倍特藥業(yè)等4個(gè)公司,位居第四,有10個(gè)受理號;積大制藥和宜昌人福藥業(yè)位列第五,有9個(gè)受理號。
積大制藥2020年申報(bào)的9個(gè)受理號中,注射劑品種申報(bào)的項(xiàng)目3個(gè),口服固體制劑申報(bào)的項(xiàng)目4個(gè),原料申報(bào)的項(xiàng)目兩個(gè)。阿莫西林膠囊已于2020年4月份通過一致性評價(jià)。
一致性評價(jià)工作的開展對提升我國制藥行業(yè)整體水平,保障公眾用藥安全有效,增強(qiáng)醫(yī)藥企業(yè)國際競爭力,具有十分重要的意義。通過一致性評價(jià)是藥企面臨的一項(xiàng)緊要任務(wù),體現(xiàn)著藥企創(chuàng)新能力及綜合實(shí)力,即便面對當(dāng)下疫情,這項(xiàng)工作也不敢懈怠……2021年,我們來了!